-
아주대 연구진이 줄기세포와 드레싱제를 결합하는 방식으로 상처 치료를 위한 새로운 소재를 개발했다. 이를 활용하면 상처 치유의 속도를 개선할 뿐 아니라 줄기세포 치료의 효율성과 안정성을 동시에 높일 수 있어 새로운 치료의 패러다임을 제시할 수 있을 것으로 보인다. 김문석 교수(응용화학과·대학원 분자과학기술학과)·최상돈 명예교수(첨단바이오융합대학·대학원 분자과학기술학과) 연구팀은 줄기세포 유도형 창상 치유 드레싱 제형을 개발했다고 밝혔다. 해당 내용은 ‘P1 물질이 적재된 가교 결합 소장 점막하 조직 지지체를 기반으로 줄기세포 이동을 활용한 상처 치유 증진(Enhanced wound healing via stem cell migration using a substance P1-loaded cross-linked small intestinal submucosa scaffold)’이라는 논문으로 약효 향상 분야 국제 저널인 <저널 오브 컨트롤드 릴리즈(Journal of Controlled Release)>에 8월 온라인 게재됐다. 이번 연구에는 아주대 대학원 분자과학기술학과 석사과정을 마친 김신아 졸업생과, 대학원 분자과학기술학과 석사과정의 김예진 학생이 제1저자로 참여했다. 난치성 질환 치료제 활용을 위한 의료·친환경 소재를 개발하고 있는 ㈜메디폴리머(대표 김문석)도 연구에 함께 했다. 줄기세포(stem cell)는 인체의 세포와 조직을 이루는 근간이 되는 세포로, 반복적 분열·재생산을 통해 자기 복제가 가능하다. 또한 여러 특수화된 세포로 분화할 수 있는 독특한 능력을 지니고 있다. 이러한 특성 덕분에 기존 약물 치료나 수술만으로는 한계가 있던 여러 난치성 질환의 치료와 손상 조직의 재생 치료에 폭넓게 활용되고 있다.상처가 발생하면 우리 몸은 염증 반응과 세포 재생 과정을 통해 손상 부위를 회복하려 하지만, 심한 손상이나 만성 상처의 경우 자연적인 회복만으로는 충분하지 않다. 이에 줄기세포 기반 치료법이 주목받고 있으나, 외부에서 채취·배양해 환자에게 주입한 줄기세포가 상처 부위에 안정적으로 자리 잡아 치료 효과를 오래 유지하기는 쉽지 않다. 체내 이식 후의 빠른 소실과 낮은 생착률 등의 문제로 실제 임상적 적용에는 많은 제약이 따랐기 때문이다. 줄기세포가 환자의 체내에 이식된 후, 질환 부위가 아닌 다른 장기나 조직으로 이동하면서 소실되고 생착률 또한 낮아지게 되는 것. 이렇게 되면 손상된 장기나 조직 미세환경에서의 줄기세포 기능은 떨어질 수밖에 없다. 아주대 연구팀은 외부 배양 줄기세포를 활용한 치료가 가진 이러한 근본적 한계점을 극복하기 위해, 새로운 융합적 치료 전략을 제안했다. 체내 이식한 대부분의 줄기세포를 손상된 질환 부위로 정확히 이동시키기 위해 AI를 활용해 발굴한 화학유인물질인 ‘SP1 펩타이드’를 소장점막하 드레싱제에 결합해 적용하는 복합적 접근 방식을 설계한 것이다. 이 새로운 방식은 주입된 외인성 줄기세포가 상처 부위에 적용된 소장점막하조직 드레싱제로 이동해 정착하고, 장기간 상처 치료 환경을 제공할 수 있다.‘SP1 펩타이드’는 신경펩타이드 계열의 생리활성 물질로, 아주대 연구팀이 최근 AI를 기반으로 발굴한 화학유인물질(chemoattractant)이며 국내 및 미국에 특허 등록되어 있다. 이 물질은 손상된 조직 주변에 존재하는 줄기세포나 주입된 외인성 줄기세포가 상처 부위로 능동적으로 이동하도록 유도하며, 동시에 세포 내 신호 전달 경로를 활성화시켜 세포의 생존력과 증식 능력을 증대시키는 역할을 한다. 연구팀이 활용한 드레싱제는 소장점막하조직 유래 탈세포화 외기질(extracellular matrix, ECM)로, ECM의 고유한 생화학적 신호와 함께 삼차원적 인체 조직과 유사한 다공 형태 구조의 미세환경을 가지고 있다. 연구팀은 이러한 복합 전략을 활용한 창상 동물모델 실험을 통해, 단순 줄기세포 주입만으로는 얻을 수 없었던 시너지 효과를 확인했다. 화학유인물질 SP1 펩타이드와 소장점막하조직 드레싱을 동시에 적용했을 때 줄기세포가 상처 부위에 체류하는 시간이 유의미하게 연장됐고, 창상에 신생혈관 형성이 촉진되어 산소와 영양분 공급이 원활해짐으로써 상처 회복이 가속화됐다. 더불어 면역조절 효과가 동반되어 염증 반응이 조절됐고, 이는 치료 과정 중 발생할 수 있는 부작용을 현저히 줄였다.연구를 주도한 김문석 교수는 “이번 연구를 통해 줄기세포 질환 타깃 치료의 효율성과 안정성을 동시에 높일 수 있는 새로운 개념의 치료 패러다임을 제시한 셈”이라고 설명했다.최상돈 명예교수는 “난치성 창상처럼 임상적 치료가 어려운 질환에 적용될 수 있는 가능성이 높아, 조직재생의공학 분야에서 차세대 창상 치료제로 발전할 것으로 기대한다”라고 전했다. 이번 연구는 한국연구재단 미래소재디스커버리 및 미래융합파이오니어사업의 지원을 받아 수행됐다.
-
229
- 작성자통합 관리자
- 작성일2025-12-15
- 226
- 동영상동영상
-
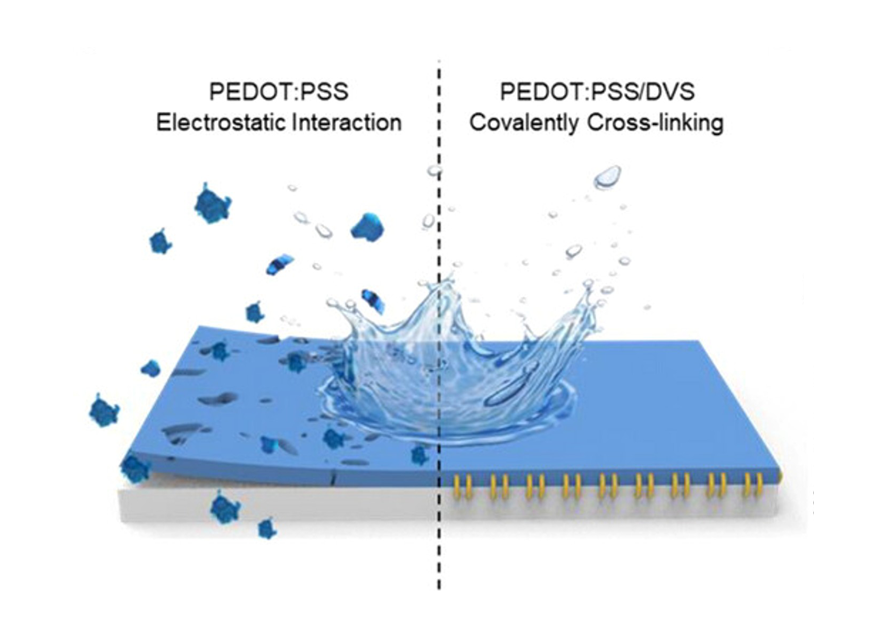
아주대학교 윤태광 교수(응용화학과·대학원 분자과학기술학과, 사진) 공동 연구팀이 반복적인 세척에도 안정적이고 땀과 같은 소량의 수(水)자원만으로도 전기 생성이 가능한 자가발전형 웨어러블 시스템을 개발했다.이번 연구 성과는 국제 저명 학술지 ‘Advanced Science’에 ‘Wearable PEDOT:PSS/DVS-coated Yarn-type transpiration-driven Electrokinetic Power Generator with High Power Efficiency and Water Stability’라는 제목으로 게재됐으며 아주대 윤태광 교수가 책임 교신저자로, 중앙대 황병일 교수, 충북대 김한슬 교수, 스웨덴 찰머스 공과대학 에르강 왕(Ergang Wang)교수는 공동 교신저자로 참여했다.전도성 고분자인 PEDOT:PSS 소자는 음전하를 띄는 PSS 덕분에 양이온 흡착이 가능해 전기 생산 성능을 극대화할 수 있지만 PSS의 친수성 때문에, 수분에 대한 안정성이 낮다는 한계가 있었다. 이에 연구팀은 가교제로 사용되던 EG(Ethylene glycol, 에틸렌글리콜) 대신 DVS(Divinyl sulfone, 디비닐술폰)을 사용해 수소결합보다 강력한 공유결합이 가능함을 확인했다.가교제가 사용되지 않은 PEDOT:PSS 소자는 5번의 세척 후에 전압 및 전류 생산량이 초기 대비 0.87과 0.51%로 크게 낮아졌고, EG가 사용된 소자는 25.4와 16.1%를 보였다. 반면, 연구팀의 DVS가 사용된 소자는 54.8과 47.7%의 유지율을 보여 향상된 세척 안정성을 보였다.개발된 소자는 땀 농도의 전해질을 에너지원으로 사용하였을 때 최대 112µW/cm³의 전력을 생산할 수 있으며, 수 차례의 구김이 있고 난 뒤에도 성능은 안정적이었다. 25개의 소자를 직렬 및 병렬 연결하여 상용 캐패시터를 충전하였습니다. 충전에 성공하면서 인체의 땀을 이용한 자가발전형 웨어러블 시스템 활용 가능성을 보였다.윤태광 교수는 “이번 연구를 통해 전도성 고분자인 PEDOT:PSS의 수분 안전성을 획기적으로 향상함으로써 세척 가능하며 에너지 생성 성능이 우수한 섬유형 에너지 하베스팅 시스템을 개발했다”라며, “다양한 분야에서 응용을 통해 후속 연구를 계속 진행할 계획”이라고 전했다.이번 연구는 과학기술정보통신부·한국연구재단의 ‘해외우수연구기관 협력허브 구축사업’의 지원을 받아 수행되었다.(사진) 섬유형 에너지 하베스팅 시스템 개략도(사진) 지속적인 전기 에너지 생성 시스템
-
227
- 작성자통합 관리자
- 작성일2025-12-15
- 257
- 동영상동영상
-
- 안정성·기능성 높은 차세대 경구용 치료제로 새 패러다임 제시- 네이처 포트폴리오 <실험 및 분자 의학(EMM)> 게재우리 학교 연구진이 자가면역질환을 일으키는 특정 단백질의 과도한 활성을 선택적으로 억제할 수 있는 화합물을 개발했다. 이에 안정성과 기능성이 높은 차세대 경구용 자가면역질환 치료제로서 새로운 패러다임을 제시할 수 있을 것으로 기대된다.첨단바이오융합대학·대학원 분자과학기술학과 김욱·최상돈 교수팀은 자가면역질환의 주요 원인으로 알려진 내재성 톨유사수용체의 과도한 활성을 선택적으로 억제하는 신규 저분자 화합물을 개발하는 데 성공했다고 밝혔다. 해당 내용은 ‘ETI41 및 ETI60의 발견: 자가면역질환 치료를 위한 선택적 내재성 톨유사수용체 억제제(Discovery of ETI41 and ETI60: Novel Selective Endosomal Toll-Like Receptor Inhibitors for the Treatment of Autoimmune Diseases)’라는 제목으로 네이처 포트폴리오(Nature Portfolio) 발행 저명 학술지 <실험 및 분자 의학(Experimental & Molecular Medicine)>에 9월1일 온라인 게재됐다. 이번 연구에는 아주대 의학과 서창희 교수(류마티스내과학교실), 응용화학과 김문석 교수가 함께 참여했다. 대학원 분자과학기술학과 정의석·이왕희 박사가 제1저자로 실험과 분석에 주도적으로 참여했다. 자가면역질환 및 염증성질환 신약 개발 기업 ㈜에스앤케이테라퓨틱스(대표 최상돈)도 함께 참여했다. 인체의 면역체계가 본래의 방어 기능을 넘어 자가 조직을 공격함으로써 발생하는 자가면역질환은, 발병 원인이 명확하게 밝혀지지 않은데다 증상과 발현 부위가 다양하다. 때문에 암과 심혈관 질환에 이어 많은 수의 환자가 고통을 받아온 난치병 중 하나다. 대표적인 자가면역질환으로 류마티스 관절염, 1형 당뇨, 전신홍반루푸스, 건선, 염증성 장 질환(크론병) 등이 있다. 자가면역질환의 치료는 과도하게 활성화된 면역 반응을 억제해 면역체계의 과잉 반응을 줄이는 방식으로 이루어지는데, 기존의 치료제는 전신의 면역을 광범위하게 억제하는 방식으로 작용한다. 때문에 ▲감염 위험 증가 ▲장기 독성 노출 등 여러 부작용에 노출될 수밖에 없다. 더욱이 치료에 고가의 주사제가 필요한 경우가 많아, 환자들이 비용과 병원 방문에 부담을 느낄 수밖에 없는 상황이다. 때문에 환자의 편의성을 높이고 비용은 낮추며, 안정성과 기능성을 갖춘 경구용 치료제의 개발이 필요하다. 아주대 연구팀은 이러한 문제를 극복하기 위해 자가면역질환의 발병에 핵심적으로 관여하는 내재성 톨유사수용체(Endosomal Toll-like Receptors, TLR)의 신호 경로에 주목했다. 내재성 TLR 3, 7, 8, 9는 세포 내 소기관에 위치하면서 병원체 유래 핵산을 인식해 강력한 면역 반응을 일으키지만, 과도하게 활성화되는 경우 만성 자가면역질환을 유발한다는 점에 착안해 기존과 다른 차별화된 접근법을 도입한 것.연구팀은 인공지능 컴퓨팅을 활용한 구조-활성도 관계(Structure-Activity Relationship, SAR) 기반의 약물 설계 기법을 통해 여러 유도체를 합성하고, 이 과정에서 ETI15라는 후보물질을 발굴했다. 이후 후보물질의 분자 구조를 최적화해 ETI41(Endosomal TLR Inhibitor 41)과 ETI60(Endosomal TLR Inhibitor 60)을 개발하는 데 성공했다.새로 개발한 저분자 화합물 ‘ETI41’과 ‘ETI60’은 세포 내 TLR 3, 7, 8, 9에 대해서만 강력한 억제 효과를 보였으며, 세포 표면 TLR(TLR 1, 2, 4, 5, 6)에는 영향을 미치지 않아 높은 선택성을 입증했다. 연구팀은 분자 도킹(molecular docking)과 표면 플라즈몬 공명(surface plasmon resonance) 분석을 통해 두 화합물이 TLR 7과 TLR 9의 Site 1 결합 부위와 직접 상호작용한다는 사실을 규명했다. 이는 주요 염증 신호 경로(NF-κB, MAPK, IRF7 등)의 활성 억제로 이어진다.신약 후보 물질인 ETI41과 ETI60이 내재성 톨유사수용체에 어떻게 선택적으로 결합·작용하는지를 분자 수준에서 정밀하게 보여주는 이미지. 이를 통해 전신의 면역을 광범위하게 억제하지 않고, 특정 면역 감지 수용체만을 선택적으로 억제할 수 있다.연구팀이 새로 개발한 저분자 화합물은 전임상 동물실험에서도 우수한 효능이 확인됐다. 만성 염증성 피부 질환인 건선의 마우스 모델에서 하루 60mg/kg의 경구 투여만으로 표피 두께가 67% 감소했고, 염증성 사이토카인(IL-17A, IL-23) 발현은 90% 이상 억제됐다. 또한 온몸에 염증이 생기는 질환인 루푸스의 모델 마우스에서는 30mg/kg 투여 시 항 이중가닥 DNA항체(anti-dsDNA) 생성이 80% 억제, 신장 내 IgG 침착이 70% 이상 감소하는 등 주요 질환 지표가 현저히 개선됐다. 뿐만 아니라 300mg/kg의 고용량 투여에도 독성 징후가 관찰되지 않아, 차세대 경구용 자가면역질환 치료제로서의 안전성과 가능성을 동시에 입증했다.연구를 주도한 김욱 교수는 “이번에 개발한 두 화합물은 기존 면역억제제와 달리 면역 반응 전체를 억제하는 것이 아니라 내재성 TLR 과활성화를 선택적으로 억제하는 세계 최초의 후보물질”이라며 “자가면역질환의 치료 효율성과 안정성, 편의성 측면에서 여러 장점을 가지고 있다”라고 설명했다. 연구팀은 앞으로 후속 연구를 통해 류마티스관절염, 염증성 장 질환, 심혈관계 염증 질환 등의 여러 난치성 자가면역질환으로 적용 범위를 확대해 나가면서 글로벌 신약 개발까지 도전한다는 계획이다. 이번 연구는 한국연구재단 기초연구사업(글로벌기초연구실사업 및 중견연구)과 경기도 지역협력연구센터(GRRC) 사업의 지원을 받아 수행됐다. 특허 출원과 기술이전이 완료되어 전임상을 마쳤고, 현재 ETI41을 중심으로 후속 임상 개발이 진행 중이다.* 제일 위 그림 설명 - 아주대 연구팀이 개발한 신규 저분자 화합물 ETI41과 ETI60의 치료 효능을 자가면역질환 동물모델을 통해 설명하는 이미지. 건선 모델 7주령 C57BL/6 마우스에 ETI41 또는 ETI60를 매일 60mg/kg 경구 투여한 결과, 피부 두께(표피 및 진피)가 현저히 감소했으며, 염증세포 침윤과 염증성 사이토카인(IL-17A 및 IL-23) 발현이 크게 억제됐다. 육안 및 조직학적 관찰에서 염증과 각질 증가가 완화되는 치료 효과를 분명히 확인할 수 있었다.
-
225
- 작성자통합 관리자
- 작성일2025-12-15
- 218
- 동영상동영상
-
- <사이언스(Science)> 8월호 표지논문 게재- 김동진 박사 제1저자, 김창환 박사과정생 공동저자로 참여아주대 연구팀이 물 위에서 자유자재로 움직이는 곤충 부채다리 소금쟁이를 모사한 초소형 로봇을 세계 최초로 개발했다. 곤충의 기동 메커니즘 연구를 기반으로 한 생체 모사 로봇으로, 해당 내용은 글로벌 학술지 <사이언스(Sceince)>의 8월호 표지논문으로 실렸다. 고제성 교수(기계공학과) 연구팀은 물 위에서 초고속 기동을 펼치는 소금쟁이과 곤충 라고벨리아(Rhagovelia)의 기동 원리를 밝혀내고 이를 모방한 초소형 반수생 로봇을 개발했다고 밝혔다. 해당 내용은 ‘초고속 탄성-모세관 팬을 통한 반수생 곤충과 로봇의 민첩한 기동 제어(Ultrafast elastocapillary fans control agile maneuvering in ripple bugs and robots)’라는 제목으로 글로벌 학술지 <사이언스(Science)> 8월호에 표지논문으로 게재됐다. 아주대 기계공학과 김동진 박사후연구원(위 사진 제일 왼쪽)이 제1저자로, 김창환 박사과정생(위 사진 가운데)이 공동저자로 참여했고 고제성 교수(위 사진 제일 오름쪽)가 교신저자로 함께 했다. 미국 조지아공과대학(Georgia Institute of Technology) 사드 밤라(Saad Bhamla) 교수와 캘리포니아대학버클리(UC Berkeley) 빅터 M. 오르테가-히메네스(Victor M. Ortega-Jimenez) 교수도 함께 참여했다. 아주대 연구팀은 생물을 모사한 로봇의 개발을, 조지아공대·캘리포니아대버클리 연구팀은 생물의 기동 메커니즘 연구를 맡았다.소금쟁이과 곤충 라고벨리아(Rhagovelia)는 다리의 부채꼴 구조를 이용해 흐르는 물살에도 빠르게 나아가고 급회전을 구사하는 등 민첩하게 움직일 수 있다(0.05초 만에 최대 96도 급선회). 하지만 이러한 기동 메커니즘에 대해서는 그동안 명확하게 밝혀진 바가 없었다. 기존 연구에서는 라고벨리아 다리 끝에 부착된 부채 형태의 납작한 끈 구조가 라고벨리아의 근육에 의해 작동하는 것으로 파악해 왔으나, 아주대 공동 연구팀은 근육 에너지에 대한 의존 없이 수중 환경과의 상호작용으로 인한 움직임이라는 점을 규명해냈다. 이번 연구에 따르면 라고벨리아의 초고속 기동은 ‘탄성-모세관 현상’에 의한 것으로, 이 현상은 얇고 유연한 구조가 물의 표면장력과 탄성으로 인해 빠르게 변형되는 물리적 메커니즘이다. 라고벨리아 다리 끝의 부채꼴 구조가 물속에 들어가면 0.01초 이내에 스스로 펼쳐지고, 물 밖에서는 곧바로 접히는 것이 바로 물의 표면장력과 부채꼴 구조라는 유연한 물질 사이의 섬세한 상호작용이라는 것. ‘탄성-모세관 현상’은 거시적 구조의 분석에서는 간과되거나 무시되지만, 작은 크기 곤충의 움직임 같은 규모의 분석에서는 중요한 역할을 한다.공동 연구팀은 새롭게 발견한 기동 메커니즘을 모방해 무게 1mg의 초경량 인공 팬(fan)을 개발하고, 이를 장착한 0.23g의 초소형 로봇 ‘라고봇(Rhagobot)’을 구현해냈다. 이 초소형 로봇은 형상기억합금 기반 17mg의 인공 근육 구동기도 장착하고 있어, 기존의 반수생 로봇들보다 더욱 민첩하게 제동하고 방향을 바꿀 수 있다(1초 만에 206도 회전 가능). 기존의 초소형 로봇 연구는 곤충의 다리 구조나 근육 기반 메커니즘에 의존, 표면장력을 무시하거나 최소화할 수 있는 방향으로만 설계되어 실제 곤충 수준의 속도 조절과 제동·회전 등 복잡한 기동 구현에 한계를 보였다. 그러나 아주대 공동 연구팀은 자연계 자기형상변화(self-morphing) 구조의 원리 규명을 통해 로봇의 추진력을 효율적으로 발생시킬 수 있었다. 이번 연구를 주도한 아주대 고제성 교수는 “자연계 곤충이 가진 구조적 지능(embodied intelligence)을 활용해 물리적 구조·재료적 특성이 환경과 상호작용하면서 자연스럽게 발현될 수 있도록 구현해냈다는 점에서 의미 있는 연구”라고 말했다. 고제성 교수는 이어 “앞으로 급류 환경에서의 환경 모니터링과 재난 탐사 및 구조 활동뿐 아니라 물의 계면이 존재하는 뇌 등 생체 내 환경에도 적용될 수 있을 것으로 기대한다”라고 덧붙였다.우리 학교 기계공학과 고제성 교수는 앞서 박사과정부터 15년여간 소금쟁이를 비롯한 곤충 등 자연을 모사한 소형 로봇 연구에 매진해왔다. 지난 2017년 우리 학교에 임용된 고제성 교수의 지도로, 아주대 기계공학과에서 학사-석사-박사를 마치고 현재 박사후연구원으로 재직 중인 김동진 박사가 이번 연구에 주도적으로 참여해, 제1저자로 이름을 올렸다. 공동저자로 기여한 김창환 박사과정생 역시 아주대 기계공학과에서 학업을 시작하고 이어왔다.김동진 박사는 “이번 연구에 참여해 실제 로봇의 기능을 완성하는데 4년에 가까운 시간이 필요했고, 1만 번 이상의 실패가 이어졌다”며 “앞으로도 세상에 없던 새로운 것을 만들고, 사람들과 사회에 도움이 되는 연구를 하고 싶다”라고 전했다. 이번 연구는 한국연구재단의 우수신진연구, 기초연구실사업과 아주대학교 교내 연구비 지원을 받아 수행됐다.(위) 라고벨리아 곤충의 모습. (아래 왼쪽) 아주대 연구팀이 개발한 소형 로봇과 (아래 오른쪽) 약 1mg의 무게, 21개 끈 형태의 털로 구성된 자가변형 인공 팬(fan)8월22일 공개된 <사이언스(Science)> 표지. 아주대 국제 공동 연구팀의 연구 내용이 담겨 있다_제공 사이언스(Science)# 관련 영상 보기 : YTN사이언스 소금쟁이 본뜬 초소형 로봇 개발, 수면 위 이동 원리 규명# 관련 인터뷰 보기 : 연합뉴스"기초과학은 실패의 시간"…소금쟁이 다리 규명 성과
-
223
- 작성자통합 관리자
- 작성일2025-11-03
- 1543
- 동영상동영상
-
아주대 연구진이 ‘빛의 산란’을 활용한 광기술을 통해 미생물의 활성과 성장을 정밀하게 측정할 수 있는 기술을 개발했다. 이 기술을 이용하면 항생제 효과의 빠른 진단이 가능해 세균 감염 치료의 효율성을 높일 수 있을 전망이다. 물리학과 윤종희 교수와 생명과학과 이창한 교수 공동 연구팀은 빛의 산란 특성을 활용해 정밀하고 빠른 항생제 효과 진단 기술을 개발했다고 밝혔다. 이번 연구 내용은 ‘레이저 스페클 영상을 통한 빛의 산란 기반 빠른 항생제 효과 검출 기술(Light scattering-based screening method for rapid evaluating antibiotic effects on bacteria using laser speckle imaging)’이라는 제목으로, 저명 학술지 <저널 오브 바이올로지컬 엔지니어링(Journal of Biological Engineering)> 7월호에 게재됐다.아주대 대학원 에너지시스템학과의 김동혁 석사과정생과 생명과학과의 문성준 석박사 통합과정생이 제1저자로 참여했고, 아주대 생명과학과 이창한 교수와 물리학과 윤종희 교수는 공동 교신저자로 함께 했다. 아주대 대학원 에너지시스템학과 이종서 석사과정생과 산학 공동 연구를 수행하고 있는 기업 ㈜더웨이브톡의 조경만 대표도 공동 저자로 참여했다. 항생제는 세균 감염에 의한 질병을 치료하기 위해 널리 사용되는 약물로, 미생물을 죽이거나 성장 및 번식을 억제하는 방식으로 질병을 치료한다. 항생제는 어떤 종류의 세균에 효과적인지, 어떻게 세균에 작용하는지 등에 따라 여러 종류로 나뉜다. 항생제를 이용해 치료하기 위해서는 감염 부위의 세균이 특정 항생제에 대해 얼마나 민감한지 혹은 내성을 가지고 있는지를 평가해야 하며, 이를 통해 감염을 효율적으로 억제하고 항생제 오·남용으로 인한 내성 문제를 예방할 수 있다. 현재 항생제의 효과 진단에는 여러 방법이 있으나, 그중 ‘항생제 디스크 확산법(Disc diffusion method)’이 항생제에 의한 세균의 성장 억제를 눈으로 직접 확인할 수 있어 가장 많이 활용되고 있다. 이 방법을 활용하면 직관적으로 항생제 효과를 확인할 수 있지만, 24~48시간의 배양 시간이 필요해 빠른 항생제 처방이 어렵다는 한계가 있다. 항생제 처방이 늦어지면 치료에 효과적으로 대응하기 어렵기 때문에, 특히 패혈증(Sepsis)과 같이 빠른 치료가 필요한 상황에서는 항생제 디스크 확산법의 활용이 쉽지 않다. 이에 환자가 감염된 세균에 효과적으로 대응할 수 있는 항생제를 빠르게 선별할 수 있는 기술이 필요하다. 그동안 여러 생화학적 방법이 개발되어왔으나, 실제 임상 현장에서 널리 효과적으로 사용되는 방법은 매우 제한적인 상황이다. 특히 의료 현장에서는 여러 항생제를 빠르게 확인해야 하기 때문에 비용과 검사 시간 등의 현실적 문제를 고려하지 않을 수 없고, 이에 실제 적용 가능한 새로운 기술을 개발하는 데 어려움을 겪어 왔다. 항생제 선별 기술 중 ‘빛의 산란’을 활용한 레이저 스페클 영상(laser speckle imaging) 기술은 비침습적이고, 기존 빛의 세기를 측정하는 영상 기반 방식에 비해 민감도가 높다. 이에 이 기술을 활용한 ▲혈류 특성 확인 ▲액체 내 이물질 검사 등의 의생명 응용 연구가 많이 이뤄져 왔다. 덕분에 여러 의미 있는 연구 결과가 나왔지만, 실제 의료환경에 적용할 수 있는 항생제 효과 진단 광기술은 여전히 매우 제한적이다. 항생제 효과에 의해 달라지는 세균의 활성도 변화나 성장 억제를 정밀하게 측정해 기존의 방법보다 빠르게 그 효과를 진단할 수 있어야 실제 의료환경에 도입이 가능하기 때문이다.아주대 연구팀은 이러한 점에 착안해 빛의 산란 기반 항생제 효과 진단 기술 개발에 나섰다. 레이저 스페클 영상(laser speckle imaging)은 빛의 세기 정보를 측정하는 것이 아니라, 매질 내 발생하는 빛의 산란에 의해 상쇄 및 보강 간섭이 일어나 발생하는 레이저 스페클을 측정하는 기술이다. 매질 내의 작은 변화가 산란 특성을 크게 변화시키기 때문에, 레이저 스페클 영상은 더욱 정밀하게 대상의 정보를 측정할 수 있다. 앞서도 레이저 스페클 영상 기술을 항생제 효과 진단에 활용하려는 시도는 이뤄졌으나, 고정된 위치에서 한 샘플의 레이저 스페클 영상을 촬영해야 하기 때문에 여러 샘플을 동시에 측정해야 하는 실제 의료환경에 적용하기 어렵다는 문제가 있었다.아주대 연구팀이 연구해온 레이저 스페클 영상 기술을 통한 항생제 효과 조기 진단 기술 모식도. 미생물의 활성에 따라 변화하는 스페클 정보를 통해 항생제 효과를 진단할 수 있다아주대 연구팀은 이러한 한계를 돌파하기 위해, 광학 디퓨저를 활용하여 여러 스페클 조명을 만들고, 수초 내 영상 촬영만으로 미생물의 활성을 파악할 수 있는 기술을 개발했다. 이를 통해 항생제 효과에 의해 미생물의 활성이 억제되는 영역을 정확히 측정하고 3시간 이내 항생제 효과를 진단할 수 있음을 확인했다.물리학과 윤종희 교수는 “이번에 개발한 레이저 스페클 영상을 통해 미생물 배양 후 3시간 만에 항생제 효과를 진단할 수 있다”며 “세균에 감염된 환자들의 효과적 치료에 많은 도움을 줄 수 있을 것”이라고 말했다. 윤 교수는 이어 “빛의 산란 특성은 미생물 종류에 영향을 받지 않기 때문에 다양한 종류의 미생물과 항생제 효과 진단에 적용이 가능하다”라며 “앞으로 그 응용 범위가 더 넓어질 것으로 기대한다”라고 덧붙였다. 해당 기술은 아주대 연구팀과 산학 공동 연구를 수행 중인 ㈜더웨이브톡에 기술이전되어, 실제 의료환경에 필요한 장비로의 개발이 진행되고 있다. 이번 연구는 한국연구재단의 우수신진연구사업, G-LAMP 사업, LINC 3.0 사업, 중견연구자지원사업과 정부(과학기술정보통신부, 산업통상자원부, 보건복지부, 식품의약품안전처)의 재원으로 범부처전주기의료기기연구개발 사업단의 지원(RS-2020-KD000050)을 받아 수행됐다. * 상단 이미지 : 레이저 스페클 영상을 통한 항생제 효과 조기 진단 결과. (맨 윗줄) 24~48시간의 세균 배양 시간이 필요했던 기존의 방법에 비해 (아래 세줄) 이번 연구 결과에서는 매우 빠른 시간(3시간) 안에 항생제 효과에 의해서 미생물 활성이 억제되는 영역을 확인할 수 있다. 시간이 지나면서 둥그런 바깥 원이 선명해지는 쪽이 항생제 효과를 보이는 경우다. 세균 주위로 박테리아 자라지 못해 경계가 더 잘 드러난다.
-
221
- 작성자통합 관리자
- 작성일2025-10-15
- 1612
- 동영상동영상